¿Qué es un fluido supercrítico?
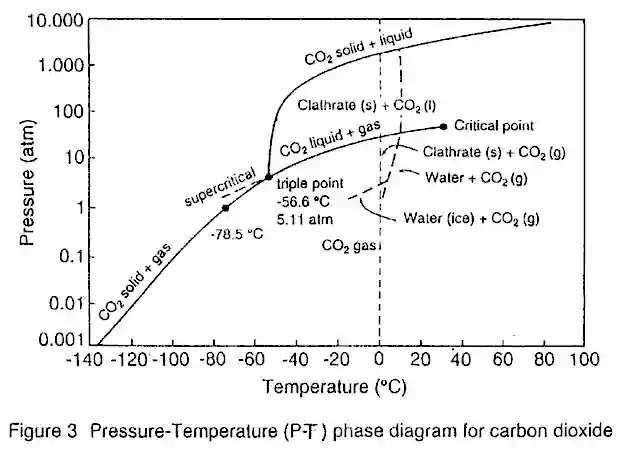
Un fluido supercrítico es cualquier sustancia a temperatura y presión por encima de su punto crítico. Puede difundirse a través de sólidos como un gas y puede disolver materiales como un líquido. Además, cerca del punto crítico, pequeños cambios en la presión o la temperatura dan como resultado
Grandes cambios en la densidad, lo que permite “afinar” muchas propiedades de un fluido supercrítico. Los fluidos supercríticos son adecuados como sustitutos de los disolventes orgánicos en una amplia gama de procesos industriales y de laboratorio. El dióxido de carbono y el agua son los fluidos supercríticos más utilizados, y se utilizan para la descafeinación y la generación de energía, respectivamente.
La extracción con fluidos supercríticos (SFE) es el proceso de separación de un componente (el extractante) de otro (la matriz) utilizando fluidos supercríticos como disolvente de extracción. Si necesita información adicional, haga clic aquí . La extracción suele ser de una matriz sólida, pero también puede ser de líquidos. La SFE se puede utilizar como un paso de preparación de muestras con fines analíticos o, a mayor escala, para eliminar material no deseado de un producto (p. ej., descafeinado) o recolectar un producto deseado (p. ej., aceites esenciales). El dióxido de carbono (CO2) es el fluido supercrítico más utilizado, a veces modificado por codisolventes como el etanol o el metanol. Las condiciones de extracción para CO 2 supercrítico están por encima de la temperatura crítica de 31°C y la presión crítica de 74 bar. La adición de modificadores puede alterar esto ligeramente. La discusión a continuación se referirá principalmente a la extracción con CO2, excepto donde se especifique.
El punto crítico (C) está marcado al final de la curva de equilibrio gas-líquido y el área sombreada indica la región del fluido supercrítico. Se puede demostrar que, mediante el uso de una combinación de cambios isobáricos de temperatura con cambios isotérmicos de presión, es posible convertir un componente puro de líquido a gas (y viceversa) a través de la región supercrítica sin incurrir en una transición de fase.
El comportamiento de un fluido en estado supercrítico se puede describir como el de un líquido muy móvil. El comportamiento de solubilidad se aproxima al de la fase líquida, mientras que la penetración en una matriz sólida se ve facilitada por las propiedades de transporte similares a las de un gas. Como consecuencia, las tasas de extracción y separación de fases pueden ser significativamente más rápidas que las de los procesos de extracción convencionales. Además, las condiciones de extracción pueden controlarse para efectuar una separación seleccionada. Se sabe que la extracción de fluidos supercríticos depende de la densidad del fluido que, a su vez, puede manipularse mediante el control de la presión y temperatura del sistema. El poder de disolución de un SCF aumenta con el aumento isotérmico de la densidad o un Isopycnic (densidad constante) aumento de la temperatura. En términos prácticos, esto significa que se puede usar un SCF para extraer un soluto de una matriz de alimentación como en la extracción líquida convencional. Sin embargo, a diferencia de la extracción convencional, una vez que las condiciones vuelven a ser ambientales, la cantidad de solvente residual en el material extraído es insignificante.
El principio básico de la extracción de SCF es que la solubilidad de un compuesto dado (soluto) en un solvente varía con la temperatura y la presión. En condiciones ambientales (25 °C y 1 bar), la solubilidad de un soluto en un gas suele estar directamente relacionada con la presión de vapor del soluto y, por lo general, es insignificante. En un SCF, sin embargo, se han informado solubilidades de soluto de hasta 10 órdenes de magnitud mayores que las predichas por el comportamiento de la ley de los gases ideales.
La disolución de solutos en fluidos supercríticos resulta de una combinación de presión de vapor y efectos de interacción soluto-disolvente. El impacto de esto es que la solubilidad de un soluto sólido en un fluido supercrítico no es una simple función de la presión.
Aunque la solubilidad de los sólidos volátiles en SCF es mayor que en un gas ideal, a menudo es deseable aumentar aún más la solubilidad para reducir el requisito de disolvente para el procesamiento. La solubilidad de los componentes en los SCF se puede mejorar mediante la adición de una sustancia conocida como agente de arrastre o codisolvente. La volatilidad de este componente adicional suele ser intermedia a la del SCF y el soluto. La adición de un cosolvente proporciona una dimensión adicional al rango de propiedades del solvente en un sistema dado al influir en la naturaleza química del fluido.
Los codisolventes también proporcionan un mecanismo mediante el cual se puede manipular la selectividad de extracción. El potencial comercial de una aplicación particular de la tecnología de SCF puede mejorarse significativamente mediante el uso de codisolventes. Sin embargo, un factor que se debe tener en cuenta al usar cosolventes es que incluso la presencia de pequeñas cantidades de un componente adicional a un SCF primario puede cambiar considerablemente las propiedades críticas de la mezcla resultante.


