¿El CO2 es polar o no polar?
El fluido supercrítico comúnmente utilizado es el dióxido de carbono (CO2). El diagrama de estado del CO2 visualiza las distintas fases (sólido, líquido, gas) en función de la presión y temperatura. El CO2, a 31.1°C y 73.8 bar, se encuentra en su estado supercrítico, en el que no se distingue entre fase líquida y gaseosa (como se muestra en la siguiente imagen).
Aumentando la temperatura y manteniendo la presión constante (73.8 bar), el CO2 permanece en estado supercrítico, y lo mismo sucede cuando se aumenta la presión y temperatura se mantiene constante (31.1°C): esto individua dos rayos – respectivamente paralelos al ejes de presión y temperatura: definen la zona en la que el CO2 se encuentra en estado supercrítico; en particular, dentro de este estado, se muestra que las posibles combinaciones de presión y temperatura varían las propiedades de solubilización del CO2. Las razones para la elección de este disolvente supercrítico son económicas (el CO2 es barato), medioambientales (el CO2 no es tóxico, no daña la capa de ozono, no contamina y no contamina los extractos) y técnicas (el CO2 crítico las condiciones se pueden alcanzar fácilmente) preocupación. SC-CO2 asume las características de un solvente no polar y es comparable al n-Hexano; tiene la característica de solubilizar compuestos poco solubles en agua debido a su naturaleza.

Si se desean aceites esenciales, la presencia de agua en la matriz interfiere negativamente en el proceso, pues se extrae junto con el aceite, por lo que es necesario removerlo en un segundo momento. Para evitar este problema, las matrices vegetales normalmente se secan antes de la extracción, a menos que se deseen extractos que contengan también sustancias polares. En este caso es necesario añadir otros disolventes (incrustantes o codisolventes) directamente a la matriz o al CO2, como etanol o agua, capaces de extraer dichos compuestos. El CO2 es químicamente inerte, por lo que se evita la isomerización, oxidación o hidrólisis de sus componentes. La ventaja de esta técnica es que al final de la extracción, el solvente puede ser removido como gas, ofreciendo la posibilidad de recuperar los compuestos concentrados extraídos. En los procesos industriales, el CO2 se puede reciclar minimizando su consumo. Esta técnica encuentra varias aplicaciones como la extracción de aceite de semillas, extracción de cafeína del café, extracción de nicotina del tabaco, etc.; también es muy conveniente a nivel industrial. Las ventajas de usar CO2 supercrítico son en gran parte de naturaleza ambiental y de “salud y seguridad” y se relacionan con una mayor inquietud acerca de la presencia de residuos de solventes orgánicos en el material para el consumo humano. Tiene buenas características de disolvente para solutos no polares y ligeramente polares. Las ventajas de usar CO2 supercrítico son en gran parte de naturaleza ambiental y de “salud y seguridad” y se relacionan con una mayor inquietud acerca de la presencia de residuos de solventes orgánicos en el material para el consumo humano. Tiene buenas características de disolvente para solutos no polares y ligeramente polares. Las ventajas de usar CO2 supercrítico son en gran parte de naturaleza ambiental y de “salud y seguridad” y se relacionan con una mayor inquietud acerca de la presencia de residuos de solventes orgánicos en el material para el consumo humano. Tiene buenas características de disolvente para solutos no polares y ligeramente polares.
Posee una conveniente temperatura crítica (31ºC). Esto permite que las extracciones se lleven a cabo a temperaturas comparativamente bajas (a menudo tan bajas como 40 o 50 ºC), lo que reduce el riesgo de daño de los compuestos termolábiles.
La mayoría de los componentes volátiles, que tienden a perderse en la hidrodestilación, están presentes en los extractos supercríticos. En parte debido a esto, los extractos obtenidos de esta manera tienden a tener sabor y gusto, que son muy apreciados por los sabrosos paneles. La extracción de materia prima natural con CO2 supercrítico, permite la obtención de extractos cuyo sabor y sabor son perfectamente respetados y reproducibles. La capacidad del fluido supercrítico para vaporizar componentes no volátiles (a temperaturas moderadas) reduce la energía gastada, en comparación con la destilación. Una vez que el exceso de presión en el equipo impide la entrada de oxígeno mientras se produce la extracción, no se producen reacciones de oxidación.
En química, a menudo hablamos de productos químicos y disolventes en términos de su polaridad. Algunas sustancias químicas son muy polares (p. ej., el agua) y otras son muy no polares (p. ej., el hexano). Cuando se describe cómo un solvente en particular disolverá un químico, hay una regla general que dice que ‘lo similar se disuelve a lo similar’. Es decir, un solvente no polar disolverá un químico no polar. Todas las grasas y aceites son no polares, por lo que lo más apropiado es utilizar un disolvente no polar.
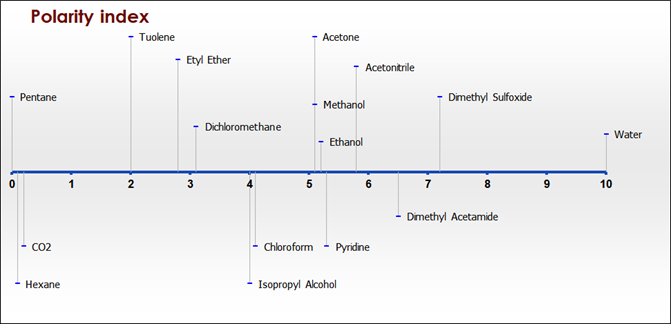
El CO2, como el pentano y el hexano, es muy poco polar, por lo que es el mejor disolvente para aceites y grasas. El agua está en el lado opuesto mientras que el etanol, el metanol y la acetona están en el medio, no muy apolares, ni muy polares.


