Bomba de codisolvente
Se puede añadir un codisolvente líquido al CO2 para aumentar su poder disolvente sobre las moléculas polares.
De hecho, el CO2 supercrítico es un buen solvente para lipofílicos (compuestos no polares como los aceites), mientras que tiene poca afinidad con los hidrofílicos (compuestos polares como los azúcares).
Los ingenieros de procesos a menudo agregan pequeñas cantidades de solventes líquidos (por ejemplo, alcohol etílico) que se solubilizan fácilmente con CO2 supercrítico para extraer polifenoles u otros compuestos con polaridad intermedia.
En solución modifican el poder disolvente del CO2 supercrítico. Esta estrategia tiene el inconveniente de que, a mayor poder disolvente, también podría significar menor selectividad del proceso y dado que el codisolvente es líquido a presión atmosférica, se recogerá en los separadores junto con los compuestos extraídos.
Todos los aceites son compuestos muy no polares. El CO2 es un disolvente no polar, por lo que existe una buena afinidad entre ellos. Los disolventes se clasifican según una escala de polaridad según su capacidad para disolver moléculas polares o no polares. El agua es el disolvente más polar, disuelve todo tipo de compuestos que pueden ser ionizados o que contienen restos hidrofílicos como azúcares, proteínas, aminoácidos,….
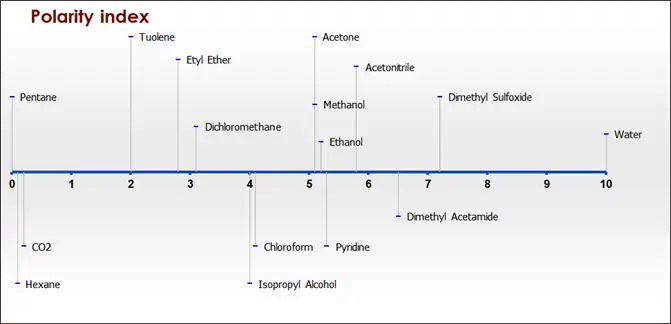
Los disolventes orgánicos, como los alcanos ligeros (hexano, heptano,…) o los hidrocarburos clorados, no disuelven estos compuestos, sino sólo moléculas hidrofóbicas nada solubles en agua como grasas, aceites, hidrocarburos, aceites esenciales,… : por lo tanto son llamados solventes no polares.
Otros disolventes como alcoholes, aminas, cetonas,… presentan un comportamiento intermedio. La mayoría de los fluidos supercríticos se comportan como solventes no polares que exhiben una fuerte afinidad con los lípidos e hidrocarburos, pero una afinidad débil con las moléculas oxigenadas o hidroxiladas.
Añadiendo un codisolvente polar o polar medio (etanol o alcoholes ligeros, ésteres o cetonas) en el porcentaje adecuado y durante un tiempo correcto y predeterminado durante la extracción, es posible afinar la polaridad total del disolvente supercrítico.
Los agentes de arrastre tienen propiedades diferentes a las del CO2 supercrítico. El punto crítico (CP) del CO2 es de 73.8 bar y 31.5° C; la CP del etanol es de 63 bar y 241° C. Una descripción matemática requiere química computacional para mostrar cómo los agentes de arrastre interactúan con el CO2. Baste decir que el CO2 estará en la fase supercrítica y los agentes de arrastre estarán en la fase líquida. Esto cambia las características solventes del CO2 y mejora los rendimientos de extracción.


